일반적으로 산소라고 하면 2개의 산소 원자(O)가 결합되어 만들어진 이원자 분자(O₂)를 의미합니다. 이러한 산소는 인류가 살아가는 주변 환경의 상온(15~25℃)과 상압(1기압)에서 기체 상태로 존재하는데, 고체 상태로 만들려면 영하 218.79℃(산소의 어는점)의 온도에서나 가능합니다.
모든 것을 얼린다고 알려진 액체질소의 어는점이 영하 210℃라는 것을 고려했을 때 그보다 낮은 온도입니다. 즉, 고체 산소는 만들기 어렵습니다.

그런데 고체 산소가 시중에 판매되고 있어서 의문이 생깁니다. 이산화탄소를 영하 72℃ 이하의 온도에서 고체 상태로 만든 것을 드라이아이스라고 하는데, 상온·상압에 놔두면 금세 기체로 변해 사라집니다.
마찬가지로 고체 산소가 존재한다고 해도 금세 기체가 될 것이므로 제품으로 판매하기에는 한계가 있습니다. 하지만 판매 중인 제품들은 3개월 이상 지속해서 산소를 발생시킬 수 있다고 합니다. 도대체 어떻게 가능한 걸까요?
먼저 제품의 효과를 보면 산소를 발생시켜주고, 이산화탄소 및 오염물질 등을 제거해준다고 합니다. 산업안전보건법에 따른 적정 공기는 아래와 같습니다.

해당 범위를 벗어나면 생명에 위협을 받을 수 있는데, 사람이 많고 밀폐된 공간에서는 산소 농도가 떨어지고, 이산화탄소 농도는 오르게 됩니다. 특수 공간(맨홀, 터널 등)에 있는 것이 아닌 이상 적정 공기 범위에서 벗어날 일은 없으나 어쨌든 제품은 이러한 상황을 개선해주고자 하는 목적으로 보입니다.
일단 시중에 판매 중인 고체 산소 제품들은 산소 발생기라고 보는 것이 적절해보입니다. 원리를 살펴보면 초산화칼륨(KO₂)과 수산화칼슘(Ca(OH)₂), 다공성 물질(제올라이트 등)을 이용합니다.
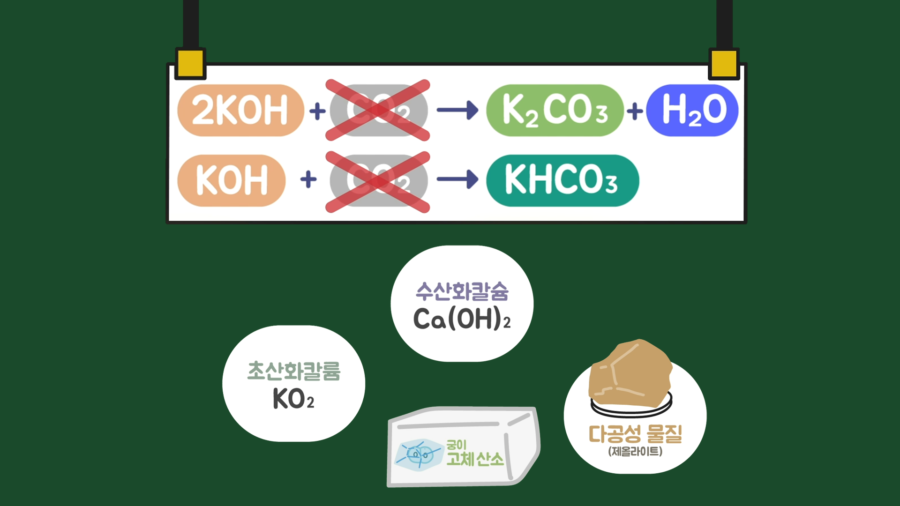
주요 물질인 초산화칼륨(KO₂)이 공기 중 수분(H₂O)과 반응해 수산화칼륨(KOH)과 산소(O₂)를 생성합니다. 이렇게 산소(O₂)를 발생시키고, 화학반응 중 만들어진 수산화칼륨(KOH)이 공기 중 이산화탄소(CO₂)와 반응해 탄산칼륨(K₂CO₃)과 물(H₂O) 또는 탄산수소칼륨(KHCO₃)을 만듭니다. 이 반응들을 통해 이산화탄소(CO₂)가 제거됩니다.
그리고 흡착제나 촉매로 활용되는 다공성 물질이 숯과 비슷한 원리로 공기 중 떠다니는 미세먼지와 냄새 분자 등을 미세기공에 흡착해 제거합니다. 또한, 앞서 3개월 이상 효과가 지속할 수 있는 내용과 관련해 다공성 물질이 공기 중 수분을 흡수하는 속도를 조절해 가능한 것으로 추정하고 있습니다.
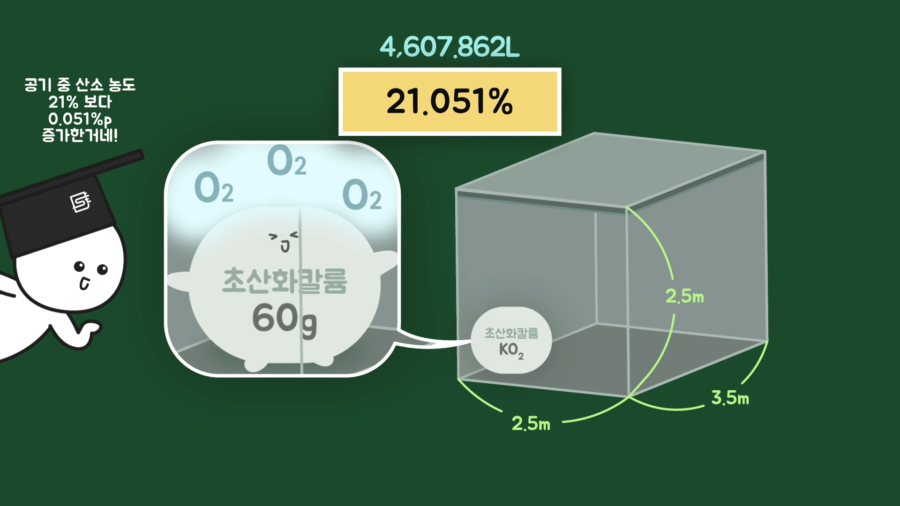
여기까지 개략적인 원리는 파악했는데, 효과가 있을까요? 계산의 편의를 위해 100% 초산화칼륨(KO₂) 60g이 표준상태(0℃·1기압)에 있다고 가정해보고 계산해보겠습니다.
초산화칼륨(KO₂, 분자량 71.096g/mol) 60g은 약 0.84mol입니다. 초산화칼륨(KO₂) 2분자가 물 1분자와 반응하여 산소 1.5분자를 만들므로 발생하는 산소는 약 0.63mol입니다. 표준상태(0℃·1기압)에서 기체 1mol의 부피는 22.4L이므로 산소 0.63mol의 부피는 14.112L입니다.

2.64평 정도 면적에 높이가 2.5m인 방의 부피는 21.875m³이고, 리터로 변환해보면 21,875L입니다. 공기 중 산소의 농도는 약 21%이므로 계산해보면 약 4,593.75L가 나옵니다.

여기에 앞서 초산화칼륨(KO₂) 60g으로부터 발생하는 산소 0.63mol의 부피인 14.112L를 더해주면 4,607.862L가 되고, 산소의 비율로 변환해보면 21.051%입니다. 즉, 산소 농도가 0.051%p 증가하는 겁니다.
그런데 앞서 언급한 다공성 물질 등을 이용해 반응 속도를 조절하게 되면 시간당 산소 발생량은 계산한 수치보다 더 떨어질 것으로 추정합니다.
이렇게 계산해봤는데, 실험 조건들이 다르기에 실제 결과와 다를 수는 있으나 확실히 말할 수 있는 것은 방의 산소 농도가 떨어지고, 이산화탄소 농도가 높다고 생각하면 환기해줌으로써 충분히 해결할 수 있는 문제라는 겁니다.
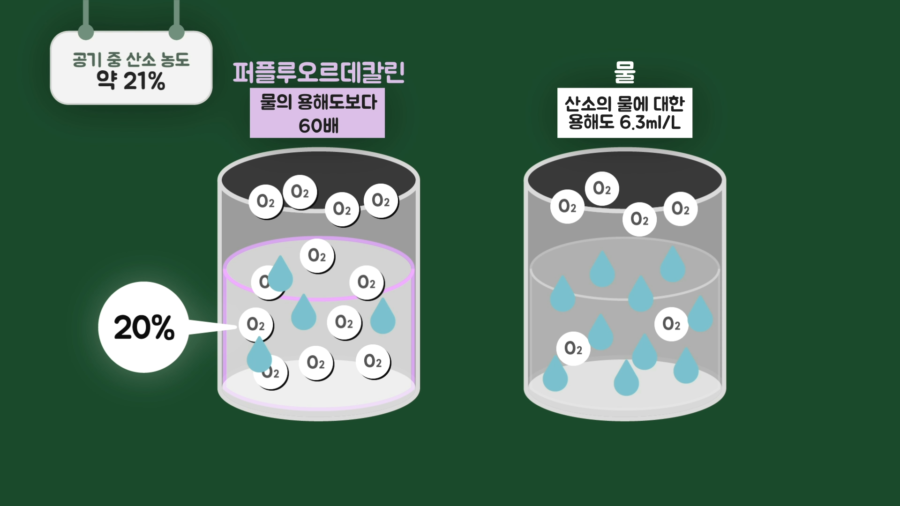
여기까지 주제와 관련한 의문들을 해결해봤는데, 액체 산소라고 불리는 물질도 있다는 것을 알고 있으신가요? 이 물질은 퍼플루오르데칼린(Perfluorodecalin, C₁₀F₁₈)이라고 합니다. 상온에서 액체 상태로 있고, 일반 공기에 21% 산소가 포함되어 있는 것과 같이 20% 정도 산소를 용해할 수 있는 액체입니다.
퍼플루오르데칼린 1L에 산소 403mL를 용해시킬 수 있는데, 이 액체에 산소를 최대한 용해시킨 뒤 쥐를 넣었을 때 4시간 정도 생존했다는 연구결과가 있습니다. 궁금증이 해결되셨나요?
– 원고 : 캘리포니아 대학교 – 산타바바라 캠퍼스 화학공학 박사과정생
Copyright. 사물궁이 잡학지식. All rights reserved

