영양소가 풍부해서 식사 대용으로 많이 찾는 미숫가루는 현미, 보리, 콩, 율무, 찹쌀, 깨 등의 여러 곡물을 쪄서 말린 다음에 볶아서 가루로 만든 식품입니다. 보통 우유나 물에 타서 설탕이나 꿀을 첨가해 잘 저어준 뒤 마시는데, 계속 저어줘도 잘 풀어지지 않아 애를 먹은 기억이 있을 겁니다. 미숫가루는 왜 자꾸 덩어리질까요?
미숫가루를 손으로 만져보면 입자가 상당히 고와서 물에 잘 녹을 것으로 생각하기 쉽습니다. 이와 관련해 미숫가루 및 여러 종류의 가루를 가지고 물이 얼마나 스며드는지 실험을 해봤습니다. 3분 정도의 시간이 흐른 뒤 물이 스며든 정도를 확인해봤을 때 가루 모두에서 잘 스며들지 않은 것을 확인할 수 있었습니다.

왜냐하면, 실험에 사용된 가루들은 소수성 물질이기 때문입니다. 소수성 물질은 물과 잘 섞이지 않으려 하나 서로 간에는 상호작용해 뭉치려는 성질이 있습니다.
그 이유는 서로 뭉쳐야 물과 접촉하는 표면적을 줄일 수 있기 때문인데, 분산된 상태로 있으면 물과 접촉하는 표면적이 넓어지고, 물과 가루 사이의 표면장력과 면적의 곱인 계면 에너지(Interfacial energy)가 높아져 불안정한 상태가 됩니다. 그래서 계면 에너지를 낮춰 안정된 상태로 되기 위해 뭉치려고 하는 겁니다.
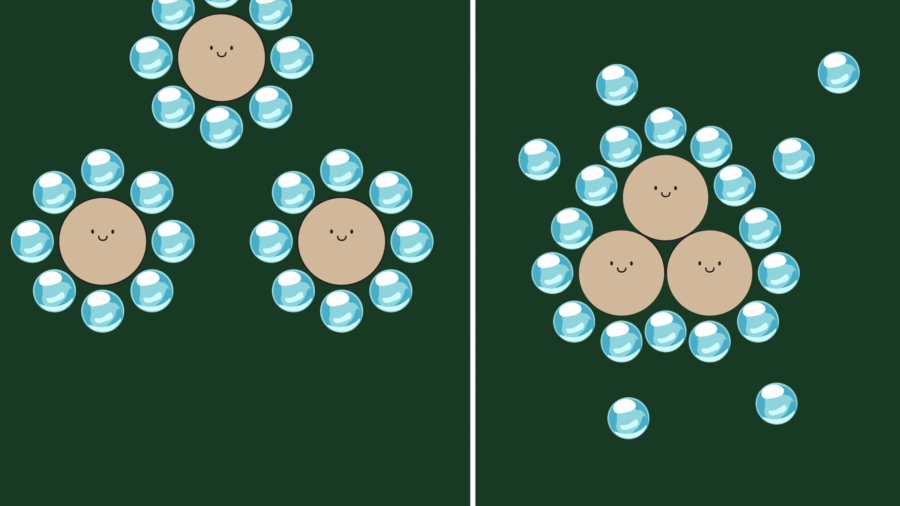
이는 물이나 우유에 미숫가루를 탈 때도 마찬가지입니다. 소수성 물질인 미숫가루가 물과 접촉하면 소수성 물질끼리 뭉치면서 아직 물과 접촉하지 않은 미숫가루를 감싸는 형태로 표면이 얇은 막으로 된 구형의 덩어리를 만들어 냅니다.

그림으로 보면 위와 같고, 물리적인 자극을 주어 소수성 상호작용으로 형성된 표면의 막을 부수면 물과 접촉한 소수성 물질끼리 다시 빠르게 뭉치면서 구형의 덩어리를 계속 만들어 냅니다.

만약 막을 계속 부수면 미소한 고체 입자, 그러니까 가루가 분산해서 물에 떠 있는 현탁액의 상태가 되는데, 물과 미숫가루는 분리된 상태로 있는 것이나 용해된 것처럼 보이게 됩니다. 우리가 미숫가루를 충분히 저어주어 마실 때가 바로 이 상태입니다.

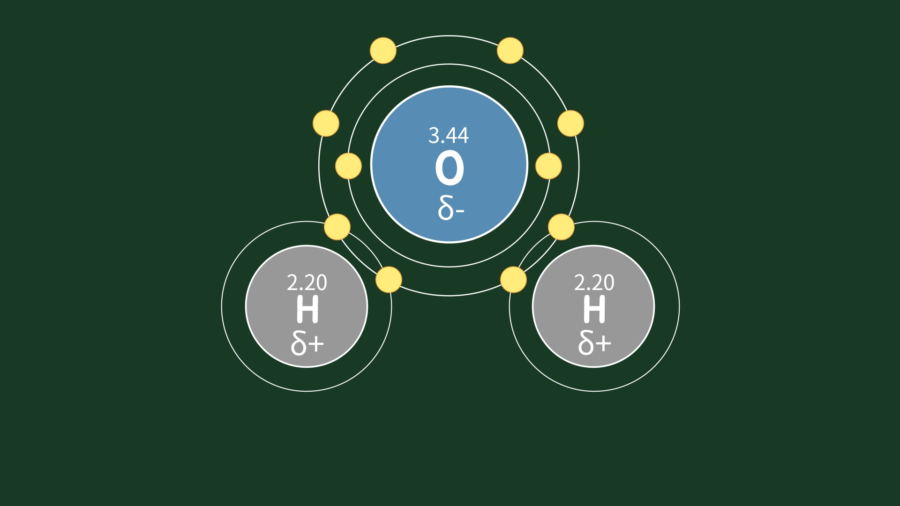
그렇다면 소금물도 같은 개념으로 이해하면 될까요? 그건 아닙니다. 화학결합에서 전자 분포가 어느 한쪽 원자에 기울어져 있는 것을 극성(polarity)이라고 하는데, 물 분자에는 극성이 있습니다.
물을 구성하는 2개의 수소 원자와 1개의 산소 원자 결합에서 산소가 수소보다 전기음성도가 크므로 산소가 전자를 더 강하게 끌어당깁니다. 이에 따라 한쪽 원자에 기울어져 있는 비대칭 구조가 만들어지고, 산소 원자는 부분적으로 음전하(-)를, 수소 원자는 부분적으로 양전하(+)를 띠게 됩니다.
그리고 소금의 분자식은 NaCl이고, 물에 넣으면 나트륨 이온(Na⁺)과 염화 이온(Cl⁻)으로 분리되어 물에 용해됩니다. 이러한 상태를 참용액(true solution)이라고 하고, 현탁액의 미숫가루와는 전혀 다른 상태입니다.
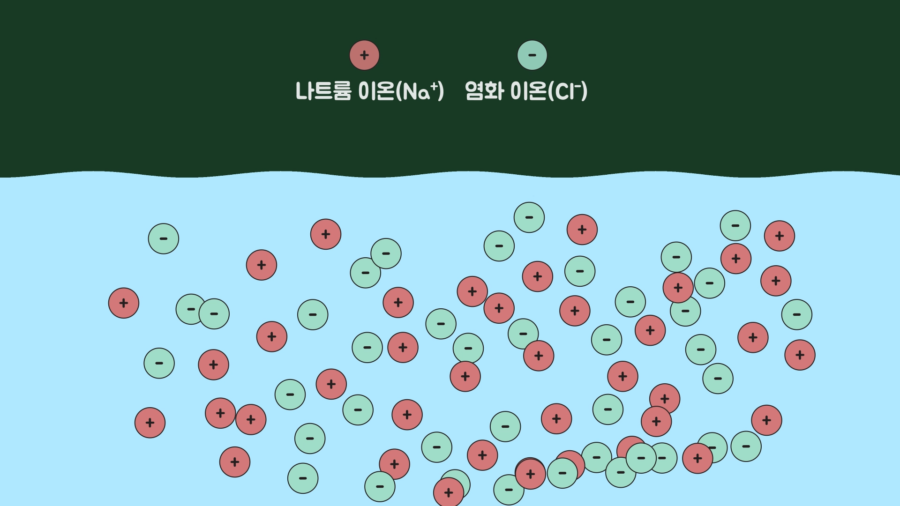
각설하고, 그렇다면 미숫가루를 탈 때 덩어리지지 않게 하려면 어떻게 해야 할까요? 믹서기를 이용해 소수성 상호작용으로 형성된 표면의 막을 빠르게 계속 부수는 방법이 있습니다. 아니면 설탕과 미숫가루를 미리 혼합하여 설탕의 거친 입자가 미숫가루 사이사이에 들어가 뭉치는 것을 방해해 덩어리지지 않도록 하는 방법이 있습니다.
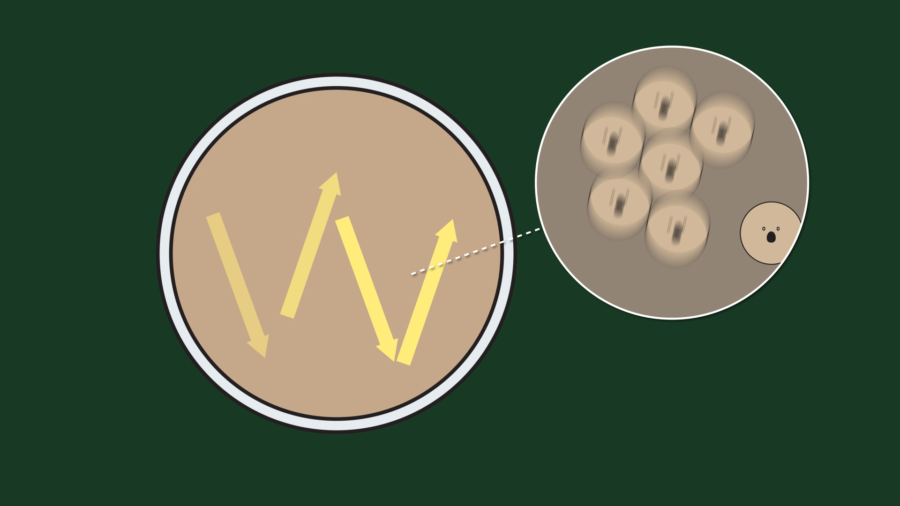
그리고 저어줄 때 원을 그리듯이 저어주면 미숫가루가 젓는 방향에 따라 같이 회전하므로 분자들 간의 충돌이 적어집니다. W자를 그리면서 저어주면 물의 흐름이 불규칙적으로 되고, 분자 간의 충돌이 많아져 도움이 됩니다. 궁금증이 해결되셨나요?
Copyright. 사물궁이 잡학지식. All rights reserved